Off-the-shelf의 기성품 인공 간 개발의 전기 마련
- 생체 내 생존능 및 기능성, 재생능이 향상된 생체 모사 인공 간 제작에 성공 -
[연구필요성]
이에, 동물의 장기에서 세포를 모두 제거함으로써 제작된 탈세포 (dECM) 생체 스캐폴드는 장기 특이적인 세포외기질, 생화학적 성분 및 미세구조는 남아 있다는 장점이 있다. 궁극적으로 손상된 간 조직을 대체하거나 재생하기 위해 탈세포 생체 간 스캐폴드와 간 구성 세포를 결합하여 생산된 생체 모사 인공 간이 개발되고 있다. 하지만 탈세포 생체 스캐폴드는 이식 후 다양한 물리화학적 반응에 의해 생체 내에서 분해되고, 염증을 유발하는 부산물을 만들어 이식 실패로 이어지는 경우가 많다. 따라서 탈세포 생체 스캐폴드의 상용화를 위해서는 이식 후에도 세포를 장기간 물리적으로 지지해주며, 유발되는 면역 억제 반응을 완화해 줄 수 있는 기술 개발이 필수적이다.
[연구성과/기대효과]
본 연구팀은 나노 산화 그래핀을 탈세포 스캐폴드에 가교결합 시키는 기술을 통해 물성 강화 및 면역원성이 감소된 생체 스캐폴드를 개발하고, 이를 이용해 이식 시 생존능이 높으면서 생체 내 기능성, 재생능이 향상된 생체 모사 인공 간을 제작하였다. 본 연구는 기존 생체 스캐폴드의 한계를 극복하고 인공 간의 이식 거부 반응 억제 및 재생능을 극대화한 차세대 조직공학 기술을 개발한 데 그 의의가 있다. 더 나아가 개발된 스캐폴드 기술은 인공 간 뿐만 아니라 다양한 장기의 스캐폴드에도 광범위하게 적용이 가능할 것으로 기대된다.
[본문]
말기 간질환은 전세계적으로 유병률이 매우 높은 질환으로, 간 이식이 궁극적인 연명 치료법이다. 전세계적으로 간 이식에 사용되는 기증 장기는 매우 부족한 실정이다. 이로 인해, 다양한 조직공학적 접근법을 통해 만들어진 인공 간이 그 대안으로 제시되고 있다. 하지만 간은 고도로 정교한 조직학적 미세구조와 생화학적 특성을 가지고 있어, 재건 시 어려움이 있다. 이 같은 한계를 극복할 차세대 기술로 동물의 장기에서 세포를 모두 제거한 탈세포 스캐폴드에 사람의 세포를 다시 주입하는 재세포화 기술이 주목받고 있다. 스캐폴드 내 기존 장기의 미세구조와 생화학적 특성을 최대한 보존할 수 있기 때문이다. 하지만 탈세포 스캐폴드를 생체 내에 이식 시 약한 물성으로 인해 쉽게 생분해되고, 분해된 물질들이 염증 반응을 유발한다는 한계가 있다.
본 연구에서는 펩타이드 결합을 통해 나노 산화 그래핀을 생체 탈세포 스캐폴드에 가교결합 시킴으로써, 기계적 물성이 크게 강화됨을 보여주었다. 특히, 나노 산화 그래핀이 스캐폴드를 분해하는 체내 효소인 매트릭스 메탈로프로테이나제 (MMP)의 활성을 직접적으로 억제하고 스캐폴드의 기계적 물성을 강화시킴으로서 효소 분해에 대한 높은 내성을 보임을 밝혀냈다. 또한, 나노 산화 그래핀이 가교된 스캐폴드 내에서 침윤된 면역세포의 프로필을 관찰했을 때, M2로의 대식세포 분극화가 촉진되고 M1으로의 분극화가 억제됨으로써 이식 후 발생되는 거부 반응 및 염증을 완화할 수 있음을 발견하였다. 특히, M2 대식세포의 아형 중 특히 M2c 대식세포에 의해 발현되는 MMP의 활성을 그래핀이 추가적으로 억제함으로써 스캐폴드를 생체 내 분해로부터 보호할 수 있음을 규명하였다.
나노 산화 그래핀이 가교 된 스캐폴드로 제작된 생체 모사 인공 간은 실제 생체 간과 유사한조직학적 구조 및 기능을 가짐을 확인하였으며, 이를 급성 간부전 및 만성 간부전이 유발된 마우스 모델에 각각 이식 시 손상된 간을 효과적으로 재생하여 간 기능을 회복시키는데 성공하였다.
이번 연구성과는 나노 산화 그래핀 가교를 통해 기존 생체 스캐폴드의 한계를 극복하고 인공 간의 이식 거부 반응 억제 및 재생능을 극대화한 차세대 조직공학 기술을 개발한 데 의의가 있다. 이는 향후 기증 장기에 대한 대안을 제공하는 다양한 생체 모사 인공 장기를 개발하여, 환자의 생명을 연장하는데 핵심 기술로 활용될 전망이다.
이 같은 연구성과는 세계적 국제 학술지인 ‘네이처 커뮤니케이션즈 (Nature Communications)“ (IF=17.694) 온라인에 2월 13일 게재되었다.
[연구결과]
Bioengineered liver crosslinked with nano-graphene oxide enables efficient liver regeneration via MMP suppression and immunomodulation
Da-Hyun Kim, Min-Ji Kim, Seon-Yeong Kwak, Jaemin Jeong, Dongho Choi, Soon Won Choi, Jaechul Ryu and Kyung-Sun Kang
(Nature Communications 14, 801)
조직공학에 널리 활용되는 탈세포 생체 스캐폴드는 이식 후 생분해 및 반응이 동반되어 이식 실패로 이어지는 경우가 많다. 본 연구에서는 나노 산화 그래핀을 사용하여 탈세포 간 스캐폴드의 생물물리학적 특성을 조절하는 전략을 제안하였다.
특히, 나노 산화 그래핀이 매트릭스 메탈로프로테이나제 활성을 직접 억제하고 스캐폴드의 기계적 물성을 강화시킴으로서 효소 분해에 대한 높은 내성을 보임을 확인하였다. 또한 가교된 스캐폴드 내에서 M2 대식세포의 분극화가 촉진되어 이식 후 거부 반응을 감소시킨다는 것을 발견했다. 특히, M2 대식세포의 아형 중 특히 M2c 대식세포에 의해 발현되는 MMP의 활성을 그래핀이 추가적으로 억제함으로써 스캐폴드를 생체 내 분해로부터 보호할 수 있음을 규명하였다.
마지막으로, 나노 산화 그래핀이 가교된 스캐폴드로 제작된 생체 공학 간을 간 부전 마우스 모델에 이식하였을 때 간 재생을 도와 손상된 간 기능이 효과적으로 회복하며 재생한다는 것을 보여주었다. 결론적으로, 나노 산화 그래핀이 가교된 스캐폴드를 이용한 인공 간은 앞으로 생체 모사 인공 장기 개발에 유용하게 활용되어 인공 장기의 실용화에 이바지할 것으로 기대된다.
[용어설명]
- ○세포외기질 성분을 분해하는 주요한 효소로서, 혈관세포, 대식세포 등 다양한 생체 내 세포에 의해 분비됨.
- ○대식세포가 미세환경과 신호에 반응하여 서로 다른 기능 상태로 전환할 수 있는 과정을 말함. M1 대식세포는 염증을 유발하는 인자들을 생성하는 반면 M2 대식세포는 항염증 반응 및 조직의 복구, 리모델링에 관여함.
[그림설명]
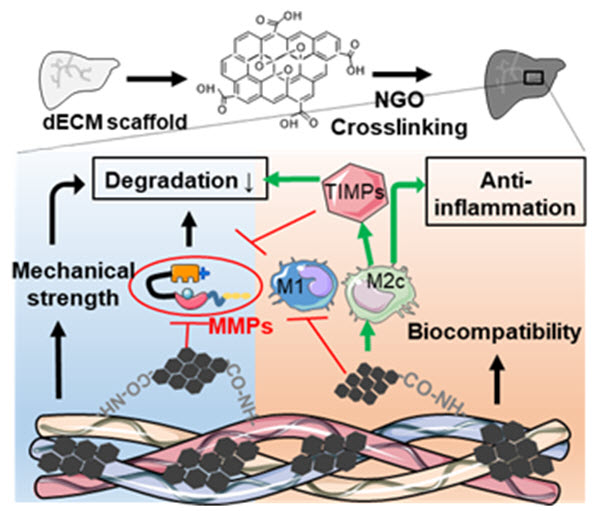
(그림1) 위 그림은 그래핀이 가교결합된 생체 스캐폴드의 특성을 보여준다. 그래핀이 세포외기질과 펩타이드 결합 (-CO-NH-)을 통해 반응하며, 반응 후에는 물성이 강화되고 MMP 효소와 직접적으로 상호작용하여 그 활성을 억제하므로 이식 후 생분해 반응이 억제됨을 알 수 있다. 또한 M2c 대식세포로의 분극화를 촉진함으로서 MMP를 억제하는 TIMP의 분비를 촉진하여 생분해 반응을 억제함과 동시에 항염증 효과가 있음을 보여주고 있다.
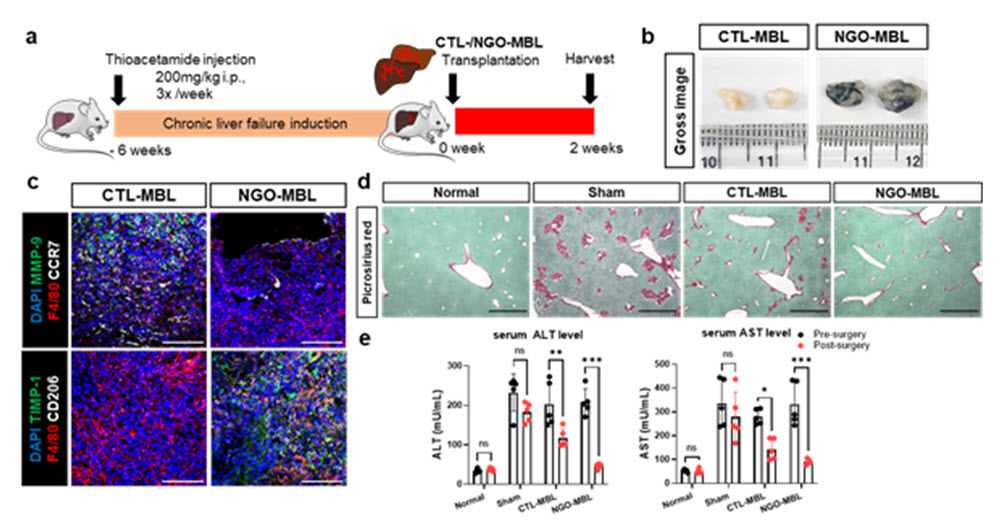
(그림2) 그래핀이 가교결합된 생체 스캐폴드와 대조군 스캐폴드로 각각 제작한 인공 간을 만성간부전이 유발된 마우스에 이식한 후 간 재생능을 비교하였다 (a). 그 결과, 대조군에 비해 그래핀 군에서 이식 2주 후 더 많은 인공 간 조직이 잔존해있는 있었으며 (b), MMP9을 분비하는 M1의 분극화는 억제되고 TIMP-1을 분비하는 M2로의 분극화가 촉진됨을 밝혀내었다 (c). 그래핀 스캐폴드를 이용한 인공 간 (NGO-MBL)의 이식을 받은 마우스의 간은 이식을 받지 않은 대조군 (Sham)에 비해 간 섬유화가 크게 감소한 것을 알 수 있다 (d). 간의 손상 정도를 나타내는 마커인 ALT, AST의 혈청 수준 또한 그래핀 군에서 유의적으로 감소함을 확인하였다 (e). 따라서, 그래핀이 가교결합된 스캐폴드 활용 시 인공 간의 생체 내 기능성 및 간 재생능이 크게 증진됨을 본 연구성과에서 발표하였다.



