파킨슨병의 원인인 알파-시누클린 응집체를 분해하는 표적분해 원천기술 개발
- 오토파지 기반 표적분해 기술을 이용해서 파킨슨병 등 다양한 퇴행성뇌질환에 대한 원인 치료제 개발 기대 -
[연구필요성]
200여 년 전 발견된 파킨슨병은 뇌에 알파 시누클린(a-synuclein) 응고체가 분해되지 않고 축적되어 발생되는 질병인데, 세계적으로 환자수가 1천만 명에 이를 정도로 대표적인 난치성 질환 중의 하나임에도 원인을 제거하는 근원 치료제가 전무하다.
[연구성과/기대효과]
순수 국내연구진이 오토파지 기반 단백질 표적분해기술인 AUTOTAC (Autophagy-targeting chimera)를 개발하였고, 이 원천기술을 이용하여 파킨슨병 모델 마우스의 뇌에서 알파 시누클린 응고체를 표적분해하는 저질량화합물 ATC161을 개발하였다.
ATC161은 GLP 독성 등 비임상시험을 완료하고 2024년 초 임상1상을 계획하고 있는 경구투여 가능한 물질로 파킨슨병 외에도 알츠하이머병, 근위축성 측색 경화증(루게릭병) 등 다양한 퇴행성뇌질환의 원인물질을 표적분해할 수 있는 플랫폼 약물이다.
의대 세포분해생물학 선도연구센터(SRC) 권용태 교수(공동제1저자: 이지훈, 성기운 학생)은 AUTOTAC 플랫폼을 치료제 개발에 적용하기 위해 ㈜오토텍바이오를 설립하고 산학공동연구를 수행하였으며, Molecular Neurodegeneration 6월 24일자 온라인판에 게재되었다. (논문명: Targeted degradation of α-synuclein aggregates in Parkinson’s disease using the AUTOTAC technology)
[본문]
□ 연구배경
전 세계 노인 인구의 10% 이상이 퇴행성 뇌질환을 앓고 있다. 그중 파킨슨병은 전 세계 65세 이상 인구의 2~3%에 해당하는 1천만 명이 고통을 받고 있다. 초고령화 사회로 진입하면서 그 숫자는 기하급수적으로 증가하고 있으나 근원 치료제는 전무하다.
파킨슨병은 뇌속의 알파-시누클린 (a-synuclein) 단백질이 응고되어 분해되지 않아 축적되면서 도파민성 신경세포가 손상 및 사멸되어 발생한다. 도파민 결핍은 운동 기능 및 인지 장애 등을 일으켜 궁극적으로 생체기능을 파괴한다.
현재 임상적으로 쓰이는 약물들은 도파민 생성을 조절하는 도파민 활성화 약제들로써 근원치료제가 아니라 대증요법이라고 할 수 있다. 따라서 파킨슨병의 근원치료제 개발을 위해서는 질병의 일차적 원인인 단백질 응고체를 환자의 뇌에서 표적분해할 수 있는 혁신적 신약개발이 절실하다.
만약 뇌에서 질병 유발 단백질 응고체를 표적분해할 수 있다면 파킨슨병 외에도 알츠하이머병 등 다양한 퇴행성뇌질환에 대한 치료제를 개발할 수 있을 것이다.
□ 연구내용
연구진은 선행연구에서 오토파지 기반 단백질 표적분해기술을 개발해서 (AUTOTAC, autophagy-targetin chimera)이라 명명했다 (22‘ Nature Communications 13:904).
AUTOTAC은 이중약물로 이루어서 1차 약물은 질병유발 물질에 결합하고, 2차 약물이 오토파지 조절인자인 p62에 결합하면, p62가 질병 단백질을 리소좀에 전달해서 분해시킨다. 본 기술을 이용하면 동일한 방식으로 대부분의 질병 관련 단백질을 표적분해할 수 있어 신약개발 플랫폼으로 이용할 수 있다.
본 연구에서는 AUTOTAC 플랫폼을 이용해서 파킨슨병의 원인인 알파 시누클린 응고체를 특이적으로 인식해서 오토파지 경유 리소좀 매개 분해를 유도하는 키메라 저질량화합물 ATC161을 개발하였다.
ATC161은 배양세포에서 정상적으로 기능을 하는 알파 시누클린 단백질을 인식하지 않고, 병인 응고체만 특이적으로 인식해서 리소좀에 의한 분해를 유도하였다. 또한, 병인 응고체의 의한 DNA 및 미토콘드리아 손상에 대한 강력한 치료 효과를 보였다.
ATC161은 파킨슨 모델 쥐에 10 mg/kg의 도즈로 경구 투여하였을 때 뇌에서 효과적으로 알파 시누클린 응고체를 분해하였다. 또한, 아교세포(glia)의 염증반응을 완화하였으며, 행동실험에서는 근력과 운동능력이 향상되었다.
ATC161은 래트와 개를 대상으로 하는 4주 반복 GLP 독성시험에서 NOAEL이 각각 240 및 500 mg/kg을 보이는 등 약물 안전성(safety)이 검정되어 2024년 1분기 임상1상이 계획 중이다.
□ 연구성과의 의미
파킨슨병은 세계적으로 1천만 명이 고통을 받고 있는 대표적 난치성질환 중의 하나인데, 현재까지 개발된 약물은 모두 대증요법이고, 근원 치료제는 전무하다. 본 연구에서는 최초로 파킨슨병을 직접적으로 일으키는 알파 시누클린 응고체를 제거할 수 있는 치료전략을 제시하였을 뿐더러, 경구 투여 가능한 임상약물을 개발하였다.
본 연구를 통해 AUTOTAC이 파킨슨병 등 다양한 퇴행성뇌질환을 치료할 수 있는 플랫폼 치료전략이 될 수 있음을 증명하였다.
이지훈 학생은 대학원 신입생으로 학부생 신분으로 인턴 기간 중 본 연구를 수행했으며, 성기운 학생은 학부에서 체육학과를 졸업하고 뒤늦게 기초의학을 공부하기 시작하여 연구성과를 거두어, 학문적 다양성의 좋은 예가 될 것이다. 성기운 학생은 또한 학생 신분으로 ㈜오토텍바이오의 임상의약센터장으로 전임상 약물효능시험을 담당하고 있어, 학교에서 개발된 초기 기술이 창업을 통한 후속개발로 이어지는 예시가 된다.
[그림설명]
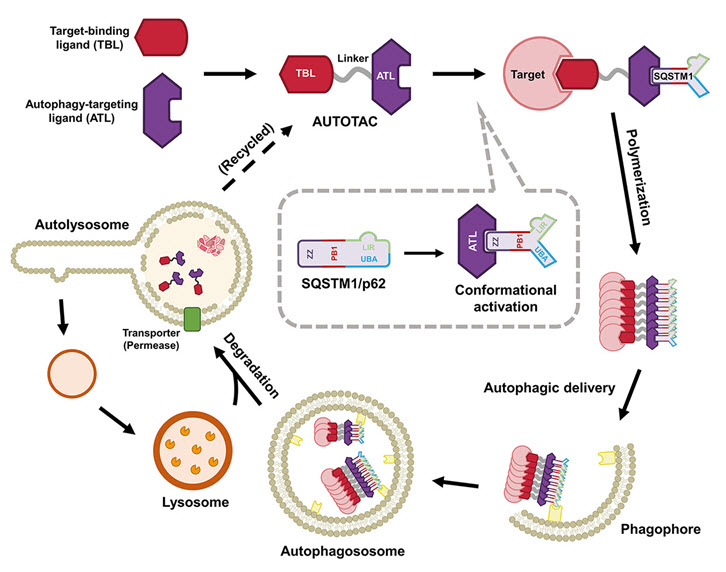
그림 1. AUTOTAC 플랫폼의 모식도 이 실제 세포내에서 어떻게 타겟 단백질을 분해시키는지 보여주는 모식도. 오토텍은 target-binding ligand 와 autophay-targeting ligand 로 구성된 bifunctional 한 약물이다. 표적 단백질과 오토파지에 중요한 역할을 하는 리셉터 단백질인 p62 에 동시에 결합하여 표적 단백질의 격리 및 리소솜에 의한 분해를 유도한다. 출처: Ji et al. Nat. Commun. 2022:13(904); Ji et al. Autophagy. 2022:18(9).
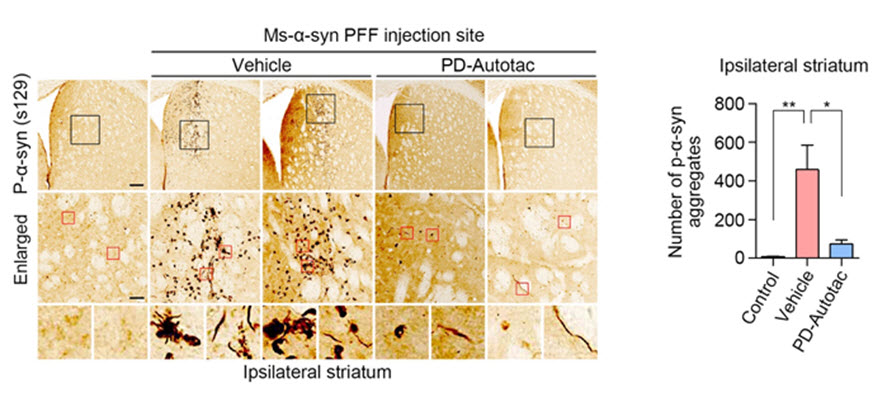
그림 2. 파킨슨병 모델 쥐의 뇌에서 ATC161(PD-Autotac)이 알파 시누클린 응고체를 제거하는 효능. Vehicle 그룹에서 보이는 알파 시누클린 응고체가 ATC161에 의해 효과적으로 분해된다. 출처: Lee et al. Mol Neurodegener. 2023:18(41).
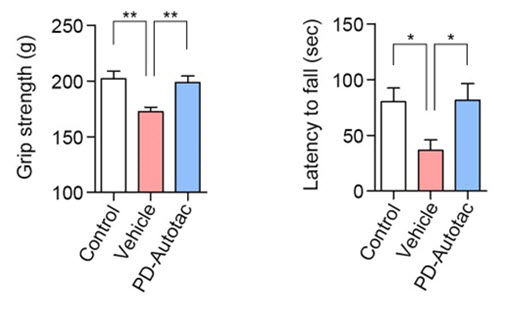
그림 3. 파킨슨병 모델 쥐에서 ATC161이 운동능력 저하를 예방함. (왼쪽 그래프) 정상쥐와 파킨슨쥐, 그리고 ATC161을 투여한 쥐에서 사지 근력을 측정. (오른쪽 그래프) 정상쥐와 파킨슨쥐, 그리고 ATC161을 투여한 쥐에서 보행능력을 측정. 출처: Lee et al. Mol Neurodegener. 2023:18(41).



